AUM Biotech-RNA Silencing mit Hilfe von FANA
Als RNA-Interferenz beziehungsweise RNA-Silencing bezeichnet man den Prozess, bei dem die Translation eines Proteins für eine bestimmte Zeit durch Injektion der entsprechenden doppelsträngigen RNA unterdrückt wird. Diese gezielte Inaktivierung von Genen findet häufig Anwendung in der Untersuchung von zellulären Prozessen in vivo.
Biologischer Hintergrund
Das Phänomen der RNA-Interferenz wurde erstmals im Fadenwurm C. elegans, später aber auch in anderen Eukaryoten nachgewiesen. Es handelt sich um einen natürlichen Abwehrmechanismus gegen Pathogene. Der Mechanismus basiert auf der Erkennung bestimmter konservierter Marker von Erregern, in diesem Fall von doppelsträngiger RNA. Doppelsträngige RNA tritt als Intermediat bei der Replikation vieler Viren auf, kann aber von den infizierten Zellen nicht selbst hergestellt werden. Als Reaktion auf das Vorhandensein dieser RNA wird der Prozess der RNA-Interferenz aktiviert.
Das Enzym RNase Dicer schneidet die doppelsträngige RNA in kleine Fragmente, die 21 bis 23 Basenpaare umfassen. Diese Fragmente werden als small interferring RNA (siRNA) bezeichnet. Sie werden anschließend in den RNA-induced silencing complex (RISC) inkorporiert. Der RISC entwindet in einer ATP-abhängigen Reaktion die Fragmente, worauf hin die nun einzelsträngigen RNA Moleküle den RISC schließlich zu komplementären mRNA Molekülen des Pathogens dirigiert und die Degradation vermittelt. RNA-Interferenz kommt in Pflanzen, Invertebraten und Vertebraten vor.
Möglichkeiten des sequenzspezifischen Knockdowns
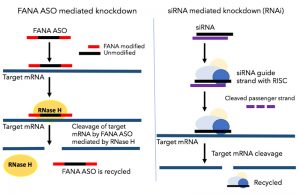
Die Erkenntnis, dass die Injektion doppelsträngiger RNA zur sequenzspezifischen Degradation der komplementären zellulären mRNA führt, ist seit längerem bekannt. Das Wissen, dass dieses Phänomen auch in höheren Eukaryoten konserviert ist, ermöglicht eine breite Anwendung in der Biowissenschaft. Die RNA-Interferenz kann zur sequenzspezifischen Inaktivierung von Genen herangezogen werden. Über synthetische siRNAs lässt sich zumindest theoretisch die Produktion jedes Proteins gezielt ausschalten. Die kurzen RNAs lösen keine Interferon Antwort aus und sind extrem sequenzspezifisch. Das Gene Silencing findet entsprechend auf der Ebene der Translation, nicht der Transkription statt. Die Inhibition ist in jedem Fall nur transient.
Der Vorteil von FANA-Oligos
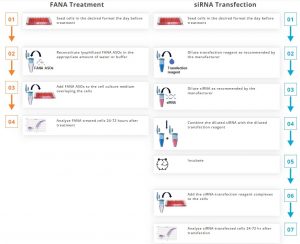
Der RNA Interferenz Pathway beinhaltet die Beteiligung des RNA-Induced Silencing Complexes (RISC). SiRNAs werden im Zytoplasma prozessiert. Im Gegensatz dazu verwenden FANA-Einzelstrang-Antisense-Oligonukleotide RNase-H-vermittelte Spaltung. Dies ist einfacher und eliminiert RISC-assoziierte Offtarget-Effekte, die häufig bei siRNA beobachtet werden. FANA- Oligos gelangen in den Zellkern und werden zur gezielten Analyse der im Zellkern vorhandenen RNA verwendet. FANAs benötigen keine Transfektionsreagenzien oder Übertragungsreagenzien. Sie werden einsatzbereit von unserem Partner AUM-Biotech hergestellt.
Unser Partner AUM Biotech stellt die für Ihre Forschungsfragen spezifischen FANA Oligos her. RNA Silencing Produkte gibt es für Bakterien, Viren und zelluläre Modelle, aber auch für Insekten, Fische und anderen Tierstudien. Wir von Hölzel Diagnostika sind Ihr lokaler Vertriebspartner und helfen Ihnen bei allen Fragen gerne weiter. Bitte zögern Sie nicht, uns zu kontaktieren.
Auf einen Blick:
| FANA Oligos | siRNAs | |
| Transfektionsreagenzien | Nicht benötigt | Unverzichtbar |
| Spezifität | Sehr hohe Spezifität für Target-DNA | siRNA Klassen Spezifität |
| RISC-assoziierte Offtarget-Effekte | Nein | Ja |
| Übergang von Basis-Zelllinein zu Primärzellen zu Tiermodellen | Ein-Schritt Prozess, einfach und anwendungsfreundlich | Umfangreiche Optimierung und Verwendung von Abgabereagenzien erforderlich |
| Basis Zelllinien | Benutzerfreundliche Handhabung- einfach die FANA Oligos mit den Zellen mischen | Transfektionsreagenzien benötigt, Optimierung der Transfektionsreagenzien erforderlich |
| Primärzellen und schwierig zu transfizierende Zellen | Benutzerfreundliche Handhabung- einfach die FANA Oligos mit den Zellen mischen | Transfektionsreagenzien benötigt, die empfindliche Zellen töten und die Biologie verändern können |
| Fisch Modelle | Funktioniert einwandfrei in Fisch-Modellen (Besonders bei Zebrafisch) | Nicht empfohlen |
| Toxizität | Nicht toxisch | Können toxisch sein |
| Stabilität | Resistent gegen Abbau durch Serum und Zellnukleasen | Mäßig |
| Ressourcen und Zeit | Sehr einfache Optimierung | Zusätzliche Reagenzien und Maschinen benötigt, Zeitaufwändige Optimierung |
| Kostenersparnis | Kostengünstigere Anwendung | Kostspielige Anwendung |
Quellen:
Eggert C. und Fischer U. (2003). RNA-Interferenz: Ein neues Werkzeug zur Analyse der Genfunktion. Biospektrum Heidelberg 9: 372-374.
https://www.spektrum.de/lexikon/neurowissenschaft/rna-interferenz/14622. Abgerufen 30.09.2019 13:45.