IBD-Erkenntnisse: Regulierung des Aktin-Zytoskeletts
Entzündliche Darmerkrankungen (IBD)
Entzündliche Darmerkrankungen (IBD) sind eine Gruppe von Magen-Darm-Erkrankungen, die durch schwere Entzündungen gekennzeichnet sind, darunter Colitis ulcerosa (UC) und Morbus Crohn.
Man geht davon aus, dass IBD aus einer Kombination mehrerer Faktoren resultiert, darunter eine Entzündungsreaktion auf kommensale Mikroben, eine Dysregulation der mukosalen Immunreaktion und ein Verlust der Integrität der Epithelbarriere (Übersicht in [1, 2]).
Die intestinale Epithelbarriere ist eine Monoschicht aus Epithelzellen, die über adhäsive Strukturen wie Tight Junctions und Adherens Junctions eine mechanische Verbindung zueinander herstellen.
Diese adhäsiven, apikalen Strukturen bestehen aus Klebe- und Gerüstproteinen, die an Zytoskelettstrukturen wie Aktinfilamente gebunden sind[2].
Die Unversehrtheit der Epithelbarriere ist für die ordnungsgemäße Aufnahme wichtiger Nährstoffe und den Schutz vor externen Krankheitserregern im Magen-Darm-Trakt von entscheidender Bedeutung; umgekehrt führt eine Störung der Darmepithelschicht zu einer undichten Barriere, die sich in Form von CED manifestieren kann.
Forscher haben versucht, die Faktoren zu verstehen, die zu CED beitragen, z. B. wie bakterielle Faktoren apikale Junktionskomplexe, die Aktivierung von Immunzellen und Zytoskelettstrukturen beeinflussen.
Im Folgenden betrachten wir die kürzlich identifizierten Mechanismen, die das Aktin-Zytoskelett bei IBD kontrollieren.
Aktin-Zytoskelett und IBD: Steuerung der Integrität der Epithelbarriere
Kritische Proteine innerhalb des apikalen Übergangskomplexes (AJC) sind bei der Pathogenese der IBD dereguliert (Übersicht in [1]).
Darüber hinaus haben neuere Massenspektrometrie-Proteomstudien der IBD an menschlichen Proben sowie an Tiermodellen messbare Veränderungen des Aktins im entzündeten Darm festgestellt [3, 4].
Diese Studien stimmen mit der übergreifenden Hypothese überein, dass Aktin eine Rolle bei der AJC und der allgemeinen Barrierefunktion spielt.
Darüber hinaus unterstützen sie frühere Erkenntnisse, dass eine Störung des Aktins durch Toxine, die das Zytoskelett beeinträchtigen, entzündliche Signalmoleküle oder bakterielle Krankheitserreger zu einem Verlust der apikalen Verbindungen führt, der mit einem Abbau der Aktinfilamente einhergeht (Übersicht in [2]).
In einer neueren Studie der Ivanov-Gruppe wurde versucht, die Rolle von b-Actin bei IBD in einem In-vivo-Modell zu definieren. Dazu wurde ein Mausmodell verwendet, bei dem b-Actin spezifisch aus Darmepithelzellen ausgeschaltet wurde, um die Rolle von Actin in der Epithelbarriere weiter zu definieren [5].
Sie stellten fest, dass diese Mäuse keine offensichtlichen gastrointestinalen Anomalien aufwiesen, was sie auf eine mögliche Kompensation durch g-Actin zurückführten.
Sie stellten jedoch fest, dass diese Mäuse eine erhöhte intestinale Permeabilität und eine ausgeprägtere Wirkung auf Dextran-Natriumsulfat, einen chemischen Auslöser der Kolitis, zeigten.
Diese Daten belegen in vivo, dass b-Actin für eine ordnungsgemäße Barrierefunktion des Epithels wichtig ist.
Progression
Aktinbindende Proteine und ihre Rolle bei IBD
In frühen Studien zum AJC wurde ein Kalziumdepletionsmodell verwendet, bei dem der AJC-Komplex internalisiert und mit reorganisierten kontraktilen F-Aktin-Ringen kolokalisiert wird [6].
Interessanterweise kolokalisierten mehrere aktinbindende Proteine (ABPs) wie Cofilin, Arp3 und Cortactin ebenfalls an diesen reorganisierten kontraktilen Ringen.
Das Motorprotein Myosin II wurde ebenfalls in der reorganisierten Ringstruktur kolokalisiert, und die Hemmung der Myosin-II-Funktion mit Blebbistatin blockierte die Demontage des AJC-Komplexes, was auf eine Rolle der ABPs bei der AJC-Regulierung hindeutet [6].
Kürzlich wurde gezeigt, dass die Abreicherung des ARP 2/3-Inhibitors ARPIN die TJ- und AJ-Architektur verändert und gleichzeitig den Aktingehalt erhöht, was letztlich die Permeabilität der Epithelbarriere erhöht [7].
Dies wurde durch In-vivo-Daten von Mäusen untermauert, die zeigten, dass ARPIN als Reaktion auf Dextran-Natriumsulfat reduziert wurde; darüber hinaus wiesen in IBD-Proben von menschlichen Patienten Bereiche mit starker Entzündung ebenfalls unterdrückte ARPIN-Spiegel auf.
Die Gruppe zeigte weiter, dass die Hemmung von ARP2/3 mit einem spezifischen Medikament, CK666, das Fortschreiten der Kolitis abschwächte [7], was die Idee unterstützt, dass eine fein abgestimmte Regulierung von ARP2/3 für die Aktinregulierung bei IBD von entscheidender Bedeutung sein könnte.
In einer weiteren Studie mit ABPs wurde untersucht, wie die Mikrobiota die Integrität der Epithelbarriere aktinabhängig regulieren kann. Sie fanden heraus, dass Butyrat, ein Produkt bestimmter Bakterien im Mikrobiom, das nachweislich die epitheliale Barrierefunktion verbessert, ein als Synaptopodin bekanntes ABP hochreguliert [8].
Sie wiesen nach, dass Synaptopodin in Aktinstressfasern und in den Tight Junctions von Epithelzellen zu finden ist. Synaptopodin-defiziente Mäuse wiesen als Reaktion auf Dextran-Natriumsulfat-Natrium einen verschlimmerten Colitis-Phänotyp auf [8].
In dieser Studie wurde ein entscheidender Mechanismus identifiziert, durch den die Mikrobiota die Funktion der Darmbarriere durch die Regulierung von Aktin über ABPs reguliert.
Andere Mechanismen, die Aktin bei der Regulierung der epithelialen Barriere regulieren
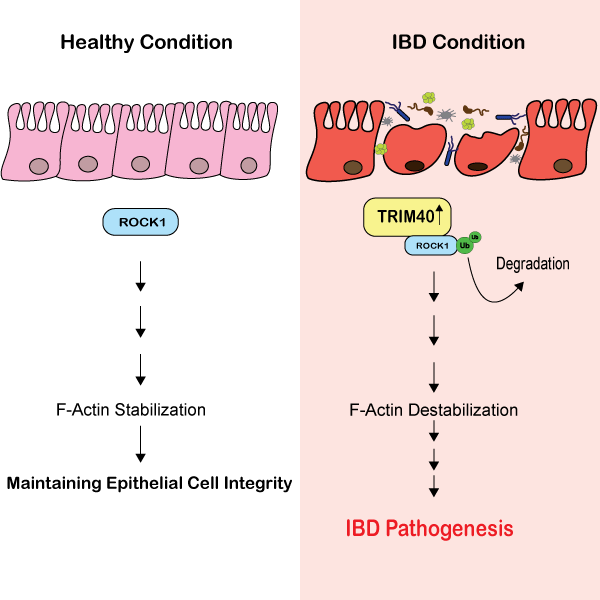
Kürzlich wurde gezeigt, dass eine Untergruppe von Patienten mit CED erhöhte Konzentrationen von TRIM40 (tripartite motif-containing protein 40) aufweist, einer Ubiquitin-E3-Ligase, von der bekannt ist, dass sie sich gegen ROCK1 richtet [9].
Die Deletion von ROCK1 durch TRIM40 unterdrückt wichtige Signalmechanismen, die normalerweise die Aktinbildung und die ROCK1/Rho-Signalübertragung fördern [9]; ein wichtiger Signalweg, der mit dem Abbau der AJC und einer verminderten epithelialen Barrierefunktion in Verbindung gebracht wird (Übersicht in [2]).
In der Studie waren TRIM40-defiziente Mäuse sehr resistent gegen chemisch induzierte Kolitis[9], was die Hypothese stützt, dass TRIM40 ein kritischer Regulationsmechanismus bei der Progression von IBD ist.
Tsukita et al. untersuchten die Rolle der Flüssig-Flüssig-Phasentrennung (LLPS), einem Mechanismus, der die rasche Erhöhung der Konzentration eines bestimmten Proteins ermöglicht und sich als wichtig für dynamische zelluläre Mechanismen erwiesen hat.
In einer kürzlich durchgeführten Studie wurde festgestellt, dass die Konzentration von Zonula occludens-1, einem Protein innerhalb der AJC, durch LLPS verändert wird und für die Bildung der Epithelbarriere wichtig ist [10].
In einer anderen Studie fanden Tsukita et al. heraus, dass Mikrotubuli die LLPS eines neuartigen Mikrotubuli-bindenden Proteins, Cordon Bleu, erleichtern [11].
Sobald es sich in der LLPS am apikalen Übergangskomplex befindet, fördert Cordon Bleu, das ein neuartiger Aktin-Nukleator ist, die Aktin-Assemblierung zur Regulierung der Epithelbarriere.
In dieser Studie wurde ein neuartiger Crosstalk-Mechanismus zwischen Mikrotubuli und Aktin identifiziert, der für die Feinabstimmung der epithelialen Barrierefunktion wichtig ist.
Zusammenfassung und Zukunftsperspektiven
Studien zeigen, dass weltweit etwa 6,8 Millionen Menschen an CED leiden, und man weiß inzwischen, dass CED ein Hauptrisikofaktor für die Entwicklung von Darmkrebs ist [12].
In einer Studie von Kanaan et al. (2010) wurde normales, dysplastisches und karzinomatöses Gewebe von drei Patienten mit IBD-assoziiertem CRC gewonnen. Nach der mRNA-Extraktion wurden Oligonukleotid-Arrays durchgeführt, um Gene zu identifizieren, die in den drei Geweben unterschiedlich exprimiert wurden.
Sie stellten fest, dass Gene, die am Aktin-Zytoskelett beteiligt sind, zwischen den drei Geweben signifikant dysreguliert waren, was einen Zusammenhang zwischen dem Aktin-Zytoskelett-Signalweg und dem Fortschreiten von normaler Dickdarmschleimhaut über Dysplasie zu IBD-assoziiertem CRC herstellt [13].
Das Verständnis der Mechanismen, durch die die epitheliale Barrierefunktion gestört wird, unter anderem durch die Regulierung der AJC- und Zytoskelett-Aktinstrukturen, könnte die Prävention von CED ermöglichen.
Key Takeaways:
- Das Aktin-Zytoskelett spielt eine entscheidende Rolle für die Zellform, die Beweglichkeit und den intrazellulären Transport in Immunzellen.
- Die Regulierung des Aktin-Zytoskeletts wird durch verschiedene Signalwege und Moleküle streng kontrolliert.
- Eine Fehlregulierung der Dynamik des Aktinzytoskeletts kann zu Fehlfunktionen des Immunsystems und zu Krankheiten führen.
- Das Verständnis der Mechanismen der Regulierung des Aktinzytoskeletts in Immunzellen kann Einblicke in die Entwicklung von therapeutischen Maßnahmen für immunbedingte Störungen liefern.
- Cytoskeleton ist marktführend im Bereich von Actin-Proteinen und Kits
Referenzen:
- Chelakkot, C., J. Ghim, and S.H. Ryu, Mechanisms regulating intestinal barrier integrity and its pathological implications. Exp Mol Med, 2018. 50(8): p. 1-9.
- Ivanov, A.I., C.A. Parkos, and A. Nusrat, Cytoskeletal regulation of epithelial barrier function during inflammation. Am J Pathol, 2010. 177(2): p. 512-24.
- Moriggi, M., et al., Contribution of Extracellular Matrix and Signal Mechanotransduction to Epithelial Cell Damage in Inflammatory Bowel Disease Patients: A Proteomic Study. Proteomics, 2017. 17(23-24).
- Cooney, J.M., et al., A combined omics approach to evaluate the effects of dietary curcumin on colon inflammation in the Mdr1a(-/-) mouse model of inflammatory bowel disease. J Nutr Biochem, 2016. 27: p. 181-92.
- Lechuga, S., et al., Loss of beta-Cytoplasmic Actin in the Intestinal Epithelium Increases Gut Barrier Permeability in vivo and Exaggerates the Severity of Experimental Colitis. Front Cell Dev Biol, 2020. 8: p. 588836.
- Ivanov, A.I., et al., Role for actin filament turnover and a myosin II motor in cytoskeleton-driven disassembly of the epithelial apical junctional complex. Mol Biol Cell, 2004. 15(6): p. 2639-51.
- Chanez-Paredes, S., et al., The Arp2/3 Inhibitory Protein Arpin Is Required for Intestinal Epithelial Barrier Integrity. Front Cell Dev Biol, 2021. 9: p. 625719.
- Wang, R.X., et al., Microbiota-derived butyrate dynamically regulates intestinal homeostasis through regulation of actin-associated protein synaptopodin. Proc Natl Acad Sci U S A, 2020. 117(21): p. 11648-11657.
- Kang, S., et al., TRIM40 is a pathogenic driver of inflammatory bowel disease subverting intestinal barrier integrity. Nat Commun, 2023. 14(1): p. 700.
- Beutel, O., et al., Phase Separation of Zonula Occludens Proteins Drives Formation of Tight Junctions. Cell, 2019. 179(4): p. 923-936 e11.
- Tsukita, K., et al., Phase separation of an actin nucleator by junctional microtubules regulates epithelial function. Sci Adv, 2023. 9(7): p. eadf6358.
- Stidham, R.W. and P.D.R. Higgins, Colorectal Cancer in Inflammatory Bowel Disease. Clin Colon Rectal Surg, 2018. 31(3): p. 168-178.
- Kanaan, Z., et al., The actin-cytoskeleton pathway and its potential role in inflammatory bowel disease-associated human colorectal cancer. Genet Test Mol Biomarkers, 2010. 14(3): p. 347-53.